正しく治験を行うために
正しく治験を行うために
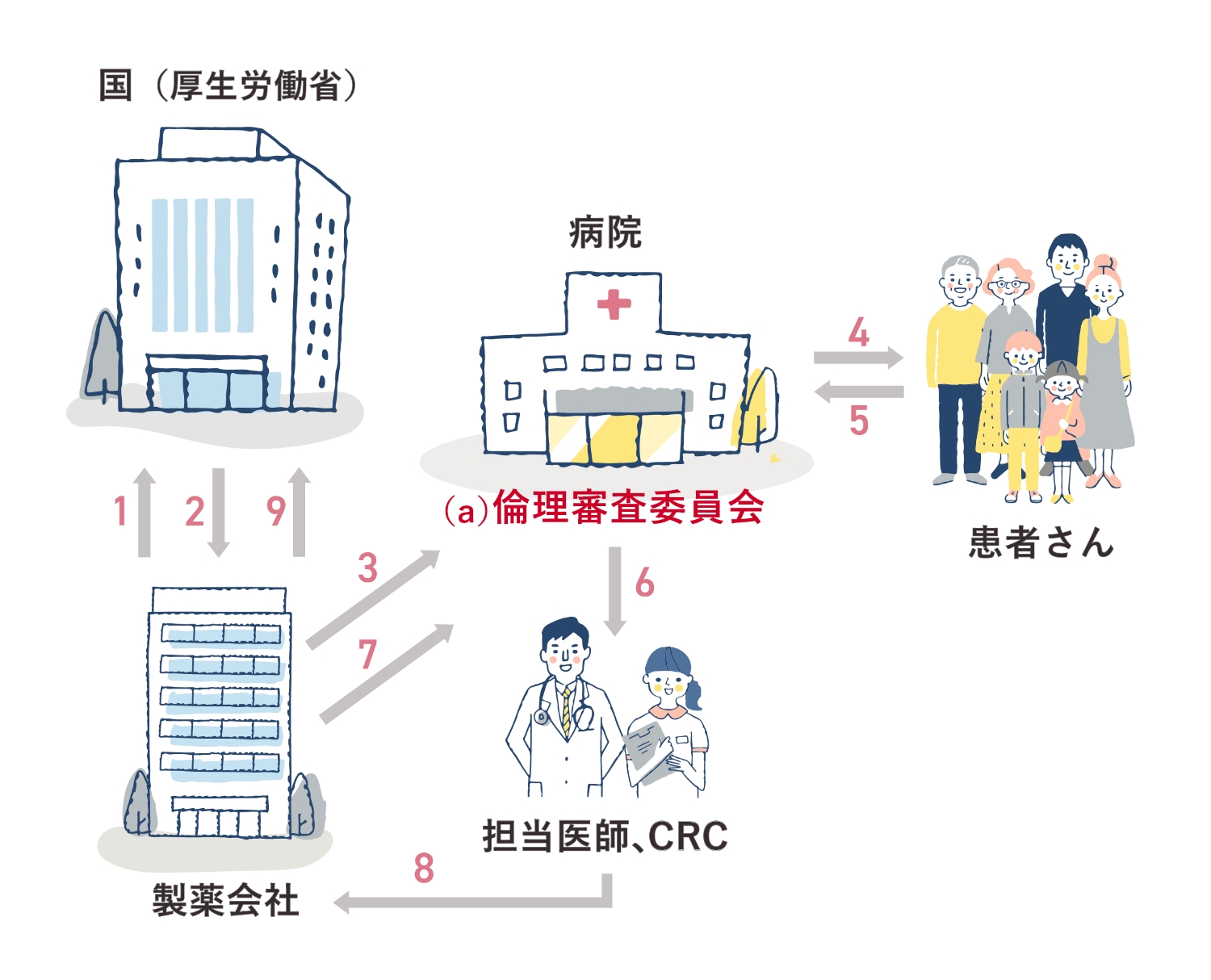
(以下の番号記号は、上図の番号と対応します。)
1. 製薬会社が、治験内容を記載した《治験実施計画書》を国(厚生労働省)に届けます。
2. 国(厚生労働省)は、《治験実施計画書》の内容に問題がないかを調べ、問題がなければ許可します。
3. 製薬会社は、各病院へ治験を依頼。
4. 治験参加希望の患者さんへ、治験担当医師などからその治験の内容等について、同意説明文書を基に説明を行う。(インフォームド・コンセント)
5. 文書により同意します。
6.7. 《治験実施計画書》や《医薬品の臨床試験の実施に関する基準》(GCP)により、治験が正しく行われているか確認。
8.9. 治験中に重大な副作用が発生した場合、病院から製薬会社に連絡し、製薬会社から国(厚生労働省)に報告します。
(a)倫理審査委員会 各病院において、医師等医療関係者だけではなく、病院と利害関係のない人や専門外の人たちにより、治験に参加する人のプライバシーや安全性に問題なく、進めることができるかどうかを確認する。
お問い合わせ・連絡先
〒950-2085 新潟市西区真砂1-14-1
国立病院機構 西新潟中央病院 治験管理室
治験管理室
TEL 025-265-3171(代表)
FAX 025-267-4316(治験管理室直通)
224-Trial-question@mail.hosp.go.jp
診療について
Medical Treatment
